تكون الدم

تكون الدم أو مكوّن الدم[1] (باللاتينية: Haematopoiesis) هي عملية يتم من خلالها إنتاج كريات الدم البيضاء والصفائح الدموية،تبدأ هذه العملية في الكيس المحي و مع تطور الجنين تنتقل إلى كبد الجنين وطحاله حتى الأشهر الخمسة الأولى من حياته. ومن ثم تصبح هذه العملية من تخصص النخاع العظمي و عند وصول الشخص سن البلوغ تنحصر في العظام المسطحة ورؤوس العظام الطويلة. عند حصول حالة طارئة تزداد كتلة النخاع العظمي المسؤولة عن تكوين خلايا الدم عن المكتوب اعلاه.وهي العملية التي يتم من خلالها تكون المحتوى الخلوي للدم، وكل هذه الخلايا مشتقه من خلايا جذعيه مكونه للدم. 10^11-10^12 خلية دم جديدة تتكون يوما في الشخص البالغ السليم من أجل المحافظة على مستويات مستقرة في الدوران المحيطي.[2][3]
خلايا جذعية مكونة للدم
[عدل]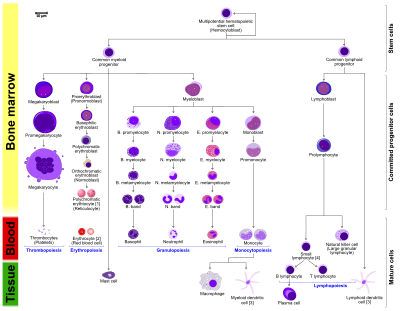
تسمى الخلايا الجذعية المكونة للدم بالخلايا الاولية ذات القوة وافرة للتخصص إلى أكثر من نوع من أنواع الخلايا، وكما انها دائمة التجدد الذاتي. هذه الخلايا هي اصل خلايا الدم بجميع انواعها. هذا النوع من الخلايا لا يبرز أي نوع من البروتينات المميزة لاي نوع من أنواع خلايا الدم مثل CD3 المميزة لخلايا اللمفاوية التائية CD19 المميزة لخلايا اللمفاوية البائية. ولكنها تبرز البروتين CD34 الذي يمكن من خلاله تعداد و معرفة وجوده باستخدام تقنية التلوين المئلق المنشط للتصنيف الخلايا. خلايا الدم الجذعية تهاجر خلال تكوين الجنين إلى كبده ونخاعه العظمي حيث يتم تحفيزهم للتخصيص إنتاج نوع معين من الدم عن طريق عوامل النمو المختلفة الموجودة في هذه الأعضاء. ومن هذه العوامل العوامل المحفزة للمستعمرات وتحفز التخصص لبناء نوع مختلف من خلايا الدم.
الخلايا الجذعية المكونة للدم موجودة في لب العظام (نقيّ العظام) ولها قدرة فريدة على تكوين جميع أنواع خلايا الدم المختلفة الناضجة. الخلايا الجذعيه المكونة للدم ذاتية التجدد، عندما تتكاثر تبقى بعض بناتها الخلايا كخلايا جذعية دون تحوّل؛ لكي لا ينتهي مصدر الخلايا الجذعية، و تسمى هذه الظاهرة بالتقسيم غير المتماثل.[4] الابنتان الأخرتان (الأسلاف النقوية و اللمفاوية) الناتجتان من الانقسام لهما القدرة على اتّباع أي من مسارات التمايز البديلة لتؤدي إلى إنتاج نوع واحد و أكثر من خلايا الدم و لكن لا تستطيع ان تجدد ذاتها. تجمع الأسلاف غير متجانس و ينقسم إلى قسمين: الخلايا الجذعية ذات التجدد الذاتي طويل الأمد والخلايا الجذعية ذات التجدد الذاتي قصير الأمد [5]، وهذه من العلامات الحيوية الأساسية في الجسم.
جميع خلايا الدم تنقسم إلى ثلاثة أنساب وهي:[6]
- الخلايا المولدة لكريات الدم الحمراء، هي خلايا دم حمراء تحمل الأكسجين. كلا الخلايا الشبكية وخلايا الدم الحمراء وظيفية و يتم إطلاقهما في الدم. و تعداد الخلايا الشبكية مؤشر على معدل تصنيع الكريات الحمراء.
- الخلايا اللمفاوية هي الأساس في المناعة المكتسبة، و يتم اشتقاقها من الأسلاف اللمفاوية المشتركة. في الأساس تنقسم الخلايا اللمفاوية إلى خلايا T و B (أنواع من خلايا الدم البيضاء)، تسمى عملية الانقسام هذه بتصنيع أو تكون الخلايا اللمفاوية.
- الخلايا النقوية والتي تشمل: الخلايا المحببة، والخلايا كبيرة النوى والبالعات وكلها مشتقة من فروع النقوية المشتركة، تشارك في الأدوار المتنوعة كالمناعة الفطرية والمناعة المكتسبة، وتخثر الدم، تكونها يسمى تكون الخلايا النقويّة.
خلايا الدم البدائية
[عدل]بوجود العوامل المذكورة أعلاه تتخصص خلايا الدم الجذعية إلى خلايا الدم البدائية، التي هي خلايا أكثر تخصص من سابقتها و تتخصص لعدد محدود من الخلايا اقل منه في الخلايا الدم الجذعية. وهي تنقسم إلى نوعين من الخلايا وهي:
•الخلايا اللمفاوية البدائية
•أرومة الخلايا الدموية
تحت تأثير عوامل النمو المختلفة تتخصص هذه الخلايا إلى خلايا أكثر تطور وذات وظائف محددة وهي خلايا الدم الناضجة مثل خلايا اللمفاوية البائية.
الخلايا اللمفاوية
[عدل]طريقة التكوين
[عدل]معظم تطور الخلايا البائية يتم داخل النخاع العظمي , بينما تتطور الخلايا التائية بالغدة الزعترية من الخلايا البدائية التائية (الزعترية) الناتجة من النخاع العظمي تحت تأثير الانترلوكين 7 المفرز من خلايا نخاع العظم اللا لمفاوية مثل الخلايا الآكلة والخلايا الدهنية. أما بالنسبة للخلايا القاتلة الطبيعية فكيفية تكونها غير معروفة بعد، وهذه الخلايا تعتبر جزء من جهاز المناعة الأصيلة (غير المتخصص) حيث تقوم بقتل الخلايا المصابة بالفيروس والخلايا الورمية.
الخلايا البائية
[عدل]هي الخلايا المنتجة للأجسام المضادة التي إما أن تكون الغلوبين المناعي المكون للمستقبل المخصص لجسم مستضاد معين معاً مع جزيئات أخرى مثل المعقد النسيجي الكبير الثاني والمستقبل المساعد CD19. أو أن يتم إفرازها إلى الدورة الدموية ليتم ضبط أي جسم غريب يدخل الجسم.
الخلايا التائية
[عدل]وهي شكليا تشبه الخلايا البائية الخامدة، ويتم تحفيزها عن طريق الأجسام المستضادة المبرزة على المعقج النسيجي الكبير الأول أو الثاني، لتكوين خلايا الارومة اللمفاوية. الخلايا التائية تنقسم إلى نوعين: •الخلايا التائية CD4+ و تسمى أيضا الخلايا التائية المساعدة لأنها تساعد الخلايا البائية بحماية الجسم من الأجسام المستضادة الموجودة خارج الخلايا وفي الدورة الدموية •الخلايا التائية CD8+ و تسمى أيضا الخلايا التائية السامة لأنها تقتل الخلايا المصابة بجسم مستضاد موجود داخل الخلايا و لذلك فهي مسؤولة عن حماية الجسم من الالتهاب الخلوية. وهذان النوعان يبرزان مستقبلات مخصصة لجسم مستضاد معين و هي المسؤولة عن معرفة الجسم المستضاد واستبعاده وحماية الجسم منه .
الخلايا القاتلة الطبيعية
[عدل]الخلايا القاتلة الطبيعية وهي خلايا لمفاوية تنتمي إلى جهاز المناعة الأصيل (غير المتخصص) لا تظهر مستقبل متخصص لنوع معين من الأجسام المستضادة وإنما تحتوي على مستقبلات ترتبط بجزيئات معينة موجودة على عدد كبير من الخلايا المصابة بالفيروس أو الخلايا الورمية.
أرومة خلايا الدم
[عدل]هذا النوع من الخلايا يمكن أن ينتج عدد كبير من السلالات مثل: •الخلايا المحببة •وحيدة الخلية ذات النواة / الخلايا الآكلة •كريات الدم الحمراء •صفائح الدموية حتى تتخصص أرومة خلايا الدم لتكون إحدى السلالات الأربعة المذكورة أعلاه فإنها تحتاج إلى خليط معين من عوامل النمو والارثيربيوتين والسيتوكينات
العدلات
[عدل]هي جزء من الجهاز المناعي غير المتخصص. وهذه الخلايا آكلة وسامة وتهاجر إلى مكان الالتهاب بمساعده عوامل الانجذاب الكيميائية. يصل طول عمر العدلة الواحدة إلى 6ساعات. ما يقارب ال1011 عدلة تنتج كل يوم في جسم الإنسان البالغ و تحتوي العدلات على حبيبات بدائية وثانوية فيها أجسام حالة (الليسوسومات) مثل إنزيم الميلوبيروكسيد و إنزيم الالاستين.
الخلايا البدينة
[عدل]الخلايا البدنية الناضجة تحتوي على حبيبات كبيرة تصبغ باللون البنفسجي، وتحتوي هذه الحبيبات على هيبارين و هستامين، ولكنها لا تحتوي على إنزيمات هيدرولاتكية. يوجد على سطح هذه الخلايا مستقبلات لجزء Fc من الغلوبين المناعي E (IgE). هذه الخلايا تلعب دور في تفاعلات الحساسية حيث يتم تحفزها عن طريق الارتباط الIgE بالمستقبلات الخاصة به الموجودة على سطح الخلايا البدينة وبهذا تقوم الخلايا البدينة بإخراج الحبيبات المذكورة أعلاه.
اليوزنيات
[عدل]تتميز هذه الخلايا بنواة تتكون من 2-3 فصوص. وتحتوي هذه الخلايا على حبيبات كبيرة تضم انزيم الهيبارين وانزيم البيروكسيد و انزيمات الهيدرولاتيكية، وهي خليا سامة تقوم بالحماية من الطفيليات و استعادها من الجسم وخاصة الديدان وحيدة الخلية ذات النواة/ الخلايا الآكلة وحيدة الخلية ذات النواة هي أكبر أنواع كريات الدم حجماً و تحتوي على عدد كبير من الحبيبات، تقوم بقتل البكتيريا ويمكن أن تقوم بتحفيز تفاعل الجسم المضاد/الجسم المستضاد الذي بدوره يقوم بمحاربة البكتريا . في بعض الأحيان تقوم وحيدة الخلية ذات النواة بالمهاجرة من الدورة الدموية إلى الأنسجة لتكون الخلايا الآكلة النسيجية . وحيدة الخلية ذات النواة و الخلايا الآكلة تبرزان بيروينات مميزة لهم وهي الCD14. الخلايا الآكلة لها وظيفة مشتركة بين الجهاز المناعي الأصيلة و المتخصصة حيث تقوم بمعالجة الأجسام المستضادة واظهارها على سطحها ليتم ملاحظتها من قبل المستقبلات الموجودة على سطح خلايا جهاز المناعة المتخصصة.
الخلايا التغصينية
[عدل]وهي خلايا ذات أشكال غير منتظمة موجودة بالدم واللمف و معظم أعضاء الجسم. هناك أنواع مختلفة من هذه الخلايا، وهي مهمة للامساك بالأجسام المستضادة الموجودة في الأعضاء الطرفية. عند وجود الالتهاب تنضج الخلايا التغصينية وتهاجر إلى الأعضاء اللمفاوية بمساعدة السيتوكينات، حيث يتم التعرف على هذه الأجسام المستضادة من خلال الأعضاء اللمفاوية وبهذا تقوم الخلايا التغصينية بتحفيز الخلايا التائية لمحاربة و استبعاد الأجسام المستضادة. وعلى الرغم من كون هذه الخلايا تنتج من أرومة خلايا الدموية إلا أنها بصفاتها تعتبر أقرب إلى الخلايا اللمفاوية
مواقع التكوّن
[عدل]
بالنسبة للأجنة يتكون الدم في مجاميع لخلايا الدم في الكيس المحي، تدعى جزر الدم . اثناء النمو، تشكيل الدم يحدث في الطحال و الكبد والغدد الليمفاوية. عندما يتطور نخاع العظام فإنه يتولى مهمة تشكيل معظم خلايا الدم في الكائن الحي. لكن نضج و تفعيل وبعض تكاثر الخلايا اللمفاوية يحدث في الأعضاء اللمفاوية الثانوية (الطحال، الغدة الزعترية و الغدد الليمفاوية) .عند الأطفال يحدث تكون الدم في نخاع العظام الطويلة مثل عظمة الفخذ و الظنبوب. عند البالغين يحدث في الحوض و الجمجمة و الفقرات والقص .[7]
خارج النقيّ
[عدل]رغم تحول وظيفة تكوين الدم من كل من الكبد، الغدة الزعترية والطحال إلى نقي العظم بعد الولادة إلاّ أنه في الحالات الضرورية تستأنف تلك الأعضاء وظيفتها السابقة بتكوين الدم و تلك العملية تسمى بتكون الدم خارج النخاع .ذلك قد يؤدي إلى زيادة في حجم تلك الأعضاء. فأثناء نمو الجنين و بسبب عدم انتهاء نمو العظام و النخاع العظمي يكون الكبد العضو الأساسي لتكون الدم و لذلك فانه يتضخم أثناء نمو الجنين.[8]
الفقاريات الأخرى
[عدل]في بعض الفقاريات يتكون الدم في النسيج الضام الرخو الذي فيه تدفق الدم بطيئ كالأمعاء، الطحال و الكلى.[9]
نضج الخلية
[عدل]كلما نضجت الخلية الجذعية تتعرض لتغييرات في التنفيذ الجيني التي تحد أنواع الخلايا التي يمكن أن تصبح و تقترب نحو خلية ناضجة معينة. هذه التغييرات في التعبير الجيني يمكن تتبعها برصد وجود البروتينات على سطح الخلية. كل تغيير متوالي يطور الخلية ويجعلها تقترب من التحول إلى الخلية النهائية، و أيضا يحد من إمكانيتها إلى التحول لخلية نهائية مختلفة النوع والوظيفة.
تحديد النوع
[عدل]هناك نوعان من وجهات النظر. للحصول على الخلايا الجذعية وخلايا الدم غير المتمايزة الأخرى في نخاع العظام، وأوضح تقرير عموما نظرية الحتمية من تكون الدم، قائلا إن مستعمرة تحفيز العوامل وعوامل أخرى من المكروية المنتجة للدم تحدد الخلايا لمتابعة مسار معين من تمايز الخلايا. هذه هي الطريقة الكلاسيكية لوصف تكون الدم . وجهة النظر الأخرى هي نظرية العشوائية: يتم تحديد خلايا الدم غير متمايزة إلى أنواع معينة من الخلايا العشوائية . وقد تم دعم هذه النظرية من خلال التجارب تبين أن ضمن مجموعة من الخلايا المنتجة للدم من الفئران السالفة، الكامنة وراء تقلب مؤشر Sca-1 ، وهو عامل الخلايا الجذعية، يقسم السكان إلى مجموعات اظهار بنسب متفاوتة من التمايز الخلوي. على سبيل المثال، تحت تأثير الإريثروبويتين (عامل كرات الدم الحمراء تمايز)، جزء من السكان من الخلايا (على النحو المحدد في مستويات Sca-1 ) متباينة في كريات الدم الحمراء بمعدل أعلى سبع مرات من بقية السكان.[10] وعلاوة على ذلك، وقد تبين أنه إذا سمح بالنمو، وهذا الصنف يعيد تثبيت الصنف الأصلي من الخلايا، بما يدعم نظرية أن هذا هو مؤشر ستوكاستيك، وعملية قابلة للعكس. مستوى آخر في أي stochasticity قد تكون مهمة في عملية موت الخلايا المبرمج والتجديد الذاتي. في هذه الحالة، تسود المكروية المنتجة للدم على بعض الخلايا على البقاء وبعض، من ناحية أخرى، لأداء الخلايا وتموت. من خلال تنظيم هذا التوازن بين أنواع مختلفة من الخلايا، يمكن للنخاع العظم يغير كمية من خلايا مختلفة إلى أن يتم إنتاجها في نهاية المطاف.[11]
عوامل النمو
[عدل]
يتم تنظيم إنتاج خلايا الدم الحمراء و البيضاء بدقة عالية في الإنسان السليم. و يزداد عدد الخلايا البيضاء عند الإنتان. يعتمد تكاثر الخلايا و تجديد ذاتها على عوامل النمو. عامل الخلايا الجذعية SCF يلعب أهم دور أساسي في تطور و التجدد الذاتي لخلايا الدم الجذعية.[12] عدم وجود هذا العامل يؤدي إلى موتها، و لكن توجد عوامل نمو أخرى هامّة وهي بروتينات سكرية تنظم نضج وتكاثر الخلايا كالإنترلوكين IL-2، IL-3، IL-6، IL-7 . عوامل أخرى تنظم عملية النضج هي العوامل المنبهة للمستعمرات (CSFs) وهذه تحفز عملية إنتاج الخلايا الملتزمة. ومنها ثلاثة أشكال العامل المحفز للبلاعم والمحببات، والعامل المحفز للبلاعم، والعامل المحفز للمحببات.[13] هذه البروتينات السكرية تعمل على تحفيز إنتاج الخلايا المحببة (العدلات والحمضات والأسسات) وهي فعالة سواء على الخلايا الأسلاف أو الخلايا النواتج النهائية (الأبناء). الإريثروبويتبن (البروتين المكون للحُمر) يعتبر عامل ضروري للخلايا النقوية الأساسية (الأسلاف النقوية) لتتحول إلى الكريات الحمراء.[14] أما الثرومبوبويتين (البروتين المكون للصفيحات) فيجعل الخلايا النقوية تتحول إلى الخلايا كبيرة النواة (الخلايا المكونة للصفيحات).[14] . CSF [10] تعني عامل الخلية الجذعية،Tpo تعني ثرومبو-بويتين، IL تعني إنترلوكين، GM-CSF تعني العامل المحفز لمستعمرات البلاعم والمحببات، Epo تعني إيرثروبويتين، M-CSF تعني العامل المحفر لمستعمرات البلاعم، G-CSF تعني العامل المحفز لمستعمرات المحببات، SDF-1 العامل المشتق من الخلية السدوية-1، FLT-3 ligand ربيطة المستقبل تيروزين كيناز III، TNF-a عامل التنخر الورمي ألفا، TGFβ عامل النمو الورمي بيتا.[15]
عوامل النسخ
[عدل]عوامل النمو تنشئ مسارات نقل الإشارة، التي تؤدي إلى تفعيل عوامل النسخ. الإشارات، التي تُستقبَل من الخلايا، هي غير رقمية. وهذا يعني أن الخلايا يمكنها تمييز الوقت والكمية والتردد. على سبيل المثال، التعبير طويل المدة لعامل النسخ PU.1 يؤدي إلى التزام النقوي، والحث قصير المدة لفعالية العامل PU.1 يؤدي إلى تشكيل الحمضات غير الناضجة.[16] مؤخرا، لوحظ بأن عوامل نسخ مثل العامل النووي المعزز لسلسلة ضوء كابا في الخلايا البائية النشطة NF-κB يمكن أن تنظمها ميكرو رنا (مثل، miR-125b) في تكوين الدم.[17] أول لاعب رئيسي لتمايز الخلايا الخذعية إلى سلائف متعددة المهام هو عامل النسخ البروتين ألفا المحفز الرابط ل (السيتوزين-السيتوزين-الأدينوزين الأدينوزين—التيميدين)CCAAT-enhancer binding protein alfa )) أو C/EBPα، الطفرات في هذا العامل مرتبطة بابيضاض الدم النقويّ الحاد (سرطان).[18] منذ أن ينقسم الطريق إلى سلالة الحمر وكبيرات النوى مولدة الصفائح أو السلالة اللمفاوية والنقوية، والتي لهم سلف مشترك، يدعى بالسلف اللمفاوي المتعدد القدرات المجهز. هناك عاملان نسخ أساسيان، PU.1 لسلالة الخلايا المحمرة ومولدة الصفيحات، و GATA-1، والتي تؤدي إلى خلايا السلف اللمفاوية المتعددة القدرات المجهزة.[19] وعوامل أخرى كال Ikaros ! ، و Gfi1 أو IRF8. ومما له أهمية عظيمة هو حدوث نفس العوامل عدة مرات في شجرة تكوين الدم. على سبيل المثال، C/EBPα في تطور الخلايا العَدِلة أو PU.1. في الوحيدات و المتغصنات. من المهم ملاحظة أن العمليات ليست أحادية الاتجاه. على سبيل مثال عامل PAX5، المهم في نضوج الخلية اللمفية البائية والمرتبط باللمفوما.[20] من المدهش أن تعطيل PAX5 وراثيا في الفئران سمح للخلايا البائية اللمفية الناضجة لأن ترجع بتحول عكسي (أي عكس النضج والتمايز) إلى أوائل سلائف نخاع العظام . وتظهر هذه النتائج أن عوامل النسخ تتصرف كراعية لمستوى التمايز، وليس فقط كمبادرة.[21]
الطفرات في عوامل النسخ متصلة بشكل وثيق بسرطانات الدم، كابيضاض الدم النقوي الحاد أو ابيضاض الدم الليمفاوي الحاد (كلها). فعلى سبيل المثال Ikaros معروف بأنه منظم للعديد من الأحداث الحيوية. الفئران من غير IKaros تفتقر إلى الخلايا البائية والخلايا القاتلة الطبيعية(من اللمفاويات السامة) والخلايا التائية.[22] يحتوي IKaros على ستة مجالات لأصابع الزنك zinc fingers، وهناك أربعة محفوظة لربط الدنا و آخران للتثنية dimerization [23]]. استنتاج بالغ الأهمية وهو أنه تبين أن أصابع زنك مختلفة تشترك في الربط إلى أمكان مختلفة في الدنا وهذا هو السبب في التأثير متعدد الأنماط ل Ikaros و انخراطه المختلف في حدوث السرطان، ولكن أساسا هي طفرات متعلقة بمرضى BCR-Abl وتعتبر علامة إنذار سيئة.[24]
النظرية المبنية على الخلايا النقوية
[عدل]لعقد من الزمان، تتزايد الأدلة أن نضوج خلايا تكوين الدم الجذعية يتبع النموذج «المستند على النقوي» بدلاً من نموذج الانقسام الثنائي المدرسي 'الكلاسيكي'. في النموذج الأخير، تولد الخلاية الجذعية المكونة للدم أولاً السلف النقوي للخلايا الحمراء المشترك (CMEP) والسلف اللمفاوي المشترك. والسلف اللمفاوي المشترك ينتج الخلايا T أو B فقط. النموذج القائم على النقوي يفترض أن الخلايا الجذعية المكونة للدم تنفصل أولاً إلى CMEP والسلف المشترك النخاعي اللمفاوي (CMLP)، الذي يولد الخلايا T & B عن طريق مرحلة السلف النقوي التائي ثنائي القدرة و السلف النقوي البائي. والفارق الرئيسي أنه في هذا النموذج الجديد، جميع الخلايا المكونة الحمراء، فروع سلالة الخلايا B وT تحتفظ بالقدرة على توليد الخلايا النقوية (حتى بعد فصل سلالتي الخلايا T و B ) ويقترح النموذج فكرة أن الخلايا المكونة الحمراء، خلايا Tو B كأنواع متخصصة prototypic من الخلايا الجذعية النقوية! [25]
انظر أيضا
[عدل]المراجع
[عدل]- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 343، OCLC:4769982658، QID:Q126042864
- ^ Semester 4 medical lectures at Uppsala University 2008 by Leif Jansson
- ^ Parslow,T G.;Stites, DP.; Terr, AI.; and Imboden JB. Medical Immunology (ط. 1). ISBN:0-8385-6278-7.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Morrison، J.؛ Judith Kimble (2006). "Asymmetric and symmetric stem-cell divisions in development and cancer". Nature. ج. 441 ع. 7097: 1068–74. Bibcode:2006Natur.441.1068M. DOI:10.1038/nature04956. PMID:16810241.
- ^ Morrison، SJ؛ Weissman, IL (نوفمبر 1994). "The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype". Immunity. ج. 1 ع. 8: 661–73. DOI:10.1016/1074-7613(94)90037-x. PMID:7541305.
- ^ "https://www.thermofisher.com/us/en/home/life-science/antibodies/antibodies-learning-center/antibodies-resource-library/cell-signaling-pathways/hematopoiesis-pluripotent-stem-cells.html". مؤرشف من الأصل في 2016-12-16. اطلع عليه بتاريخ 2014-02-03.
{{استشهاد ويب}}: روابط خارجية في|عنوان= - ^ Fernández، KS؛ de Alarcón, PA (ديسمبر 2013). "Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood". Pediatric clinics of North America. ج. 60 ع. 6: 1273–89. DOI:10.1016/j.pcl.2013.08.002. PMID:24237971.
- ^ Georgiades، CS؛ Neyman, EG؛ Francis, IR؛ Sneider, MB؛ Fishman, EK (نوفمبر 2002). "Typical and atypical presentations of extramedullary hemopoiesis". AJR. American journal of roentgenology. ج. 179 ع. 5: 1239–43. DOI:10.2214/ajr.179.5.1791239. PMID:12388506.
- ^ Zon، LI (15 أكتوبر 1995). "Developmental biology of hematopoiesis". Blood. ج. 86 ع. 8: 2876–91. PMID:7579378.
- ^ Chang، Hannah H.؛ Hemberg، Martin؛ Barahona، Mauricio؛ Ingber، Donald E.؛ Huang، Sui. "Transcriptome-wide noise controls lineage choice in mammalian progenitor cells". Nature. ج. 453 ع. 7194: 544–547. DOI:10.1038/nature06965. مؤرشف من الأصل في 2019-12-15.
- ^ Alenzi، FQ؛ Alenazi, BQ؛ Ahmad, SY؛ Salem, ML؛ Al-Jabri, AA؛ Wyse, RK (مارس 2009). "The haemopoietic stem cell: between apoptosis and self renewal". The Yale journal of biology and medicine. ج. 82 ع. 1: 7–18. PMC:2660591. PMID:19325941.
- ^ Broudy، VC (15 أغسطس 1997). "Stem cell factor and hematopoiesis". Blood. ج. 90 ع. 4: 1345–64. PMID:9269751.
- ^ Ketley، N. J.؛ A. C. Newland. "Haemopoietic growth factors". Postgrad Med J.
- ^ ا ب Molecular cell biology. Lodish, Harvey F. 5. ed. : - New York : W. H. Freeman and Co., 2003, 973 s. b ill. ISBN 0-7167-4366-3
- ^ Hauke، Ralph؛ Stefano R. Tarantolo (نوفمبر 2000). "Hematopoietic Growth Factors". Laboratory Medicine.
- ^ Engel، I؛ Murre, C (أكتوبر 1999). "Transcription factors in hematopoiesis". Current opinion in genetics & development. ج. 9 ع. 5: 575–9. DOI:10.1016/s0959-437x(99)00008-8. PMID:10508690.
- ^ O’Connell، R؛ Rao, D.؛ Baltimore, D (2012). "microRNA Regulation of Inflammatory Responses". Annual Review of Immunology. ج. 30: 295–312. DOI:10.1146/annurev-immunol-020711-075013. PMID:22224773.
- ^ Ho، PA؛ Alonzo, TA؛ Gerbing, RB؛ Pollard, J؛ Stirewalt, DL؛ Hurwitz, C؛ Heerema, NA؛ Hirsch, B؛ Raimondi, SC؛ Lange, B؛ Franklin, JL؛ Radich, JP؛ Meshinchi, S (25 يونيو 2009). "Prevalence and prognostic implications of CEBPA mutations in pediatric acute myeloid leukemia (AML): a report from the Children's Oncology Group". Blood. ج. 113 ع. 26: 6558–66. DOI:10.1182/blood-2008-10-184747. PMC:2943755. PMID:19304957.
- ^ Fiedler، Katja؛ Cornelia Brunner. "Mechanisms Controlling Hematopoiesis". مؤرشف من الأصل في 2019-11-05.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ O'Brien، P؛ Morin، P, Jr؛ Ouellette، RJ؛ Robichaud، GA (15 ديسمبر 2011). "The Pax-5 gene: a pluripotent regulator of B-cell differentiation and cancer disease". Cancer Research. ج. 71 ع. 24: 7345–50. DOI:10.1158/0008-5472.CAN-11-1874. PMID:22127921.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Cobaleda، C؛ Jochum, W؛ Busslinger, M (27 سبتمبر 2007). "Conversion of mature B cells into T cells by dedifferentiation to uncommitted progenitors". Nature. ج. 449 ع. 7161: 473–7. Bibcode:2007Natur.449..473C. DOI:10.1038/nature06159. PMID:17851532.
- ^ Wang، JH؛ Nichogiannopoulou, A؛ Wu, L؛ Sun, L؛ Sharpe, AH؛ Bigby, M؛ Georgopoulos, K (ديسمبر 1996). "Selective defects in the development of the fetal and adult lymphoid system in mice with an Ikaros null mutation". Immunity. ج. 5 ع. 6: 537–49. DOI:10.1016/s1074-7613(00)80269-1. PMID:8986714.
- ^ Sun، L؛ Liu, A؛ Georgopoulos, K (1 أكتوبر 1996). "Zinc finger-mediated protein interactions modulate Ikaros activity, a molecular control of lymphocyte development". The EMBO Journal. ج. 15 ع. 19: 5358–69. PMC:452279. PMID:8895580.
- ^ Schjerven، H؛ McLaughlin, J؛ Arenzana, TL؛ Frietze, S؛ Cheng, D؛ Wadsworth, SE؛ Lawson, GW؛ Bensinger, SJ؛ Farnham, PJ؛ Witte, ON؛ Smale, ST (أكتوبر 2013). "Selective regulation of lymphopoiesis and leukemogenesis by individual zinc fingers of Ikaros". Nature immunology. ج. 14 ع. 10: 1073–83. DOI:10.1038/ni.2707. PMC:3800053. PMID:24013668.
- ^ Kawamoto, Wada, Katsura. A revised scheme for developmental pathways of haematopoietic cells: the myeloid-based model. International Immunology 2010.
Immunology for Medical Students, Nairn & Helbert, 2nd Edition Basic Principles of Immunology, Kayser, Medical Microbiology, 2nd Edition http://instruction.cvhs.okstate.edu/histology/HistologyReference/hrhemac.htm
